Esta ley establece la relación entre la presión (P) y la temperatura (T) de un gas cuando el volumen (V) se mantiene constante, y dice textualmente:
La presión del gas es directamente proporcional a su temperatura.

Esto significa que:
Si aumentamos la temperatura, aumentará la presión.
Si disminuimos la temperatura, disminuirá la presión.
Si lo llevamos al plano matemático, esto queda demostrado con la siguiente ecuación:
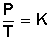
la cual nos indica que el cociente entre la presión y la temperatura siempre tiene el mismo valor; es decir, es constante.
Llevemos esto a la práctica y supongamos que tenemos un gas, cuyo volumen (V) no varía, a una presión P1 y a una temperatura T1. Para experimentar, variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y tendrá que cumplirse la siguiente ecuación:
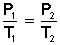
que es la misma Ley de Gay-Lussac expresada de otra forma.
Debemos recordar, además, que esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta, y tal como en la Ley de Charles, las temperaturas han de expresarse en grados Kelvin.